Введение
Антифосфолипидный синдром (АФС, APS, Antiphospholipid Syndrome) — состояние, при котором в организме образуются антитела, атакующие собственные клетки и ткани организма, и проявляющееся тромбозами и/или акушерской патологией.
В последние годы АФС принято разделять по клиническим проявлениям на две большие группы: сосудистый (васкулярный) АФС и акушерский АФС [1]. Это связано с тем, что акушерский антифосфолипидный синдром имеет не только свою клиническую картину, но и особенности развития и диагностики.
В данном материале рассматривается именно акушерский антифосфолипидный синдром, обозначаемый в англоязычной литературе как oAPS (Obstetric Antiphospholipid Syndrome) [3]. oAPS – одна из важнейших причин осложнений во время беременности, со сложным процессом диагностики и устойчивыми к базовому лечению формами. Однако в большинстве случаев он поддается коррекции [4].
Подробнее об истории АФС.
История изучения антифосфолипидного синдрома началась почти 50 лет назад. В 1975 году Нильссон с соавторами впервые описали возможную связь между выкидышами и циркулирующим антикоагулянтом, который, как предполагалось, ингибировал действие тромбопластина. Почти 10 лет спустя Грэм Хьюз и его команда доказали связь между антифосфолипидными антителами и такими клиническими проявлениями, как артериальный и венозный тромбоз, сетчатое ливедо, инсульты и акушерские заболевания, подчеркнув тот факт, что это состояние отличается от волчанки и его следует рассматривать как отдельный синдром [4].
Сведения об истинной распространенности заболевания противоречивы. Основой АФС является циркуляция антифофолипидных антител (АФА), которые выявляются у 1–5% здоровых женщин репродуктивного возраста [8]. При этом 10–29% женщин с плохими акушерскими исходами являются носителями АФА [5].
Антифосфолипидный синдром может быть как самостоятельной патологией – первичный АФС, так и осложнением других аутоиммунных заболеваний – вторичный АФС.
| Тип АФС | Процент встречаемости |
| Первичный АФС | 53,1% |
| СКВ (системная красная волчанка) | 36,2% |
| Волчаночноподобный синдром | 5,0% |
| Синдром Шегрена | 2,2% |
| Ревматоидный артрит | 1,8% |
| Системная склеродермия | 0,7% |
| Системный васкулит | 0,7% |
| Дерматомиозит | 0,5% |
Акушерской патологией при данных заболеваниях занимается именно акушер-гинеколог.
В Центре иммунологии и репродукции готовят к беременности женщин с АФС и другими системными аутоиммунными заболеваниями при невынашивании беременности и после тяжелых осложнений беременности, преэклампсии, преждевременной отслойки плаценты. Врачи центра имеют большой опыт работы с аутоиммунными заболеваниями ещё со времён института ревматологии, где несколько лет располагался филиал ЦИР.
Развитие антифосфолипидного синдрома
Антифосфолипидные антитела
Развитие антифосфолипидного синдрома обусловлено образованием антител против основных компонентов клеточной мембраны – фосфолипидов и связанных с ними белков. Такие антитела действуют на различные типы клеток, в том числе, моноциты, эндотелиальные клетки, клетки трофобласта, тромбоциты [6].
Фосфолипиды: кардиолипин, фосфатидилхолин, фосфатидилэтаноламин (PE), фосфатидилглицерол, фосфатидилэнозитол, фосфатидилсерин.
Кофакторы фосфолипидов: бета-2-гликопротеин (ß2ГП1), аннексин V, протромбин, протеины C и S.
Сосудистый АФС
При этом типе антифосфолипидного синдрома местом воздействия антител являются стенки сосудов, при повреждении которых развивается тромбоз. Тромботическое событие может возникнуть в разных сосудах: это может быть и микроциркуляторное русло, и крупные сосуды, как артериальные, так и венозные.
Акушерский АФС
Несмотря на то, что синдром первоначально был описан как единое заболевание, различие между акушерским и сосудистым АФС четко установлено в течение последних 10 лет на основании следующих наблюдений:
- в плацентах женщин с антифосфолипидными антителами редко наблюдаются признаки тромбов;
- антитела от пациентов с акушерским АФС влияют на клетки плаценты человека;
- пациенты с тромбозами в анамнезе имеют гораздо более высокий риск повторных тромботических событий, чем пациенты, у которых были только осложнения беременности [3,7,11].
При беременности в организме женщины появляется новый орган – плацента, клетки которой являются объектом действия антител. Поэтому развитие акушерского типа АФС происходит совсем иначе.
АФА оказывают прямое действие на клетки плаценты, приводя к нарушению их развития, усилению клеточной гибели, нарушению роста тканей и снижению развития сосудов, усилению свёртывания крови, а также отрицательному влиянию на процесс плацентации.[7,9]
Нормальное развитие плаценты
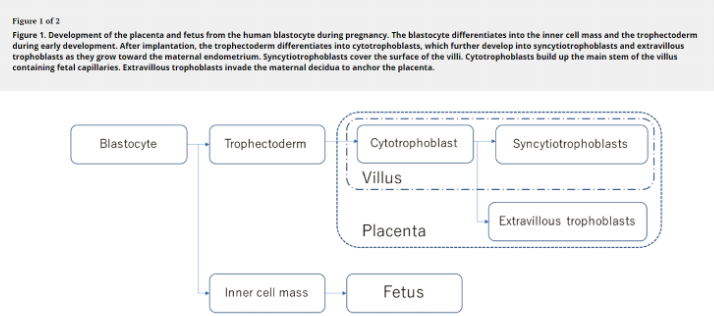
Поскольку большинство симптомов, связанных с АФС, вызваны аномалиями развития плаценты, необходимо понять, как развивается плацента при нормальной беременности.
Образование плаценты – многостадийный процесс, при котором клетки всё больше специализируются, образуя слои, выполняющие различные функции.
- Образование бластоцисты, которую составляют трофобласт и внутренняя клеточная масса.
- Трофобласт разделен на два дополнительных слоя: нижележащий слой цитотрофобласта и вышележащий слой синцитиотрофобласта. Синцитиотрофобласт представляет собой многоядерный непрерывный слой клеток, покрывающий поверхность плаценты. Он формируется в результате дифференцировки и слияния подлежащих цитотрофобластов, и этот процесс продолжается на протяжении всего развития плаценты.
- Синтициотрофобласт активно проникает в слизистую оболочку матки, которая во время беременности носит название децудиальной.
- Из цитотрофобласта и части внутренней клеточной массы образуется хорион — ворсины с сосудами, проникающими в децудиальную оболочку через слои синтициотрофобласта.
Таким образом, на этом этапе эмбрион соединен со стенкой матки через хорион и цитотрофобласт.
Важнеейшее событие плацентации
Вскоре после имплантации клетки трофобласта проникают в децидуальную оболочку матки и дифференцируются во вневорсинчатые трофобласты. Некоторые из них проникают в спиральные артерии матки, замещая мышечную стенку и эндотелиальные клетки, выстилающие сосуды, это называется инвазией трофобласта и ремоделированием спиральных артерий. Результат этого процесса — адекватно прикрепленная плацента и модифицированные артерии, которые обеспечивают адекватный непрерывный кровоток, необходимый во второй половине беременности, когда потребность плода наибольшая [10].
Этот процесс зависит от многих событий и адекватная инвазия трофобластов в материнскую децидуальную ткань очень важна для успеха беременности. Если этого не произойдет, плацента не будет обеспечивать адекватный кровоток для плода. [11]
Плацентарная недостаточность
Плацентарная недостаточность – это неспособность плаценты доставлять достаточное количество питательных веществ растущему плоду. Плацентарная недостаточность может проявляться в виде ЗВУР (задержка внутриутробного развития), преэклампсии, отслойки плаценты, антенатальной гибели плода или комбинации этих состояний.
Плацентарная дисфункция является основной причиной патологии беременных, связанной с АФС, и антитела играют важную роль в этой дисфункции. Осложнения беременности, связанные с АФС, могут быть опосредованы несколькими различными путями, не обязательно связанными с тромбогенным действием АФA [2,10,11].
Действие антифосфолипидных антител во время беременности
Антитела воздействуют на разные типы клеток, вызывая следующие изменения:
- непосредственное влияние на клетки трофобласта: их рост, развитие, перемещение, клеточную гибель;
- активация системы комплемента;
- воспалительная реакция за счет активации лейкоцитов, выработки провоспалительных веществ, в том числе, секреции TNF-альфа, внеклеточных ловушек нейтрофилов (НЕТоз);
- повышение свёртывания крови, в том числе, разрушение аннексинового щита;
- влияние на активность ДНК (так называемые эпигенетические механизмы регуляции);
- нарушение формирования сосудистой сети (ангиогенеза) за счёт нарушения соотношения проангиогенных (плацентарный фактор роста (PlGF) и антиангиогенных (растворимая fms-связанная тирозинкиназа и растворимый эндоглин) факторов;
- АФА оказывает прямой эмбриотоксический эффект, что приводит к снижению имплантации или нарушению роста эмбриона;
- децудиальные и другие клетки тоже могут подвергаться воздействию АФА [2].
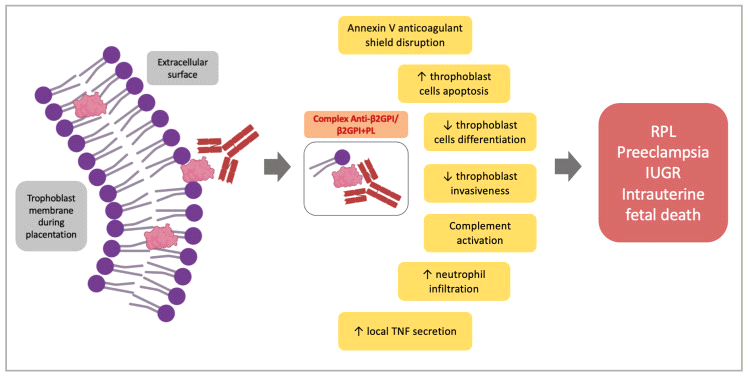
Особенности фосфолипидов при беременности. Значение β2GPI
Важной особенностью АФС является то, что для развития синдрома требуется так называемый «второй удар», то есть помимо самих антител нужно ещё какое-то событие, которое и запустит процесс.
Во время плацентации происходит экспозиция фосфолипидов (ФЛ) на внеклеточную поверхность. Это обеспечивает взаимодействие между ФЛ и бета-2-гликопротеином-I, вызывая образование комплекса анти-β2GPI/β2GPI + ФЛ. Мерони и др. считают, что этот комплекс представляет собой легкодоступную мишень для антифосфолипидных антител в отсутствие стимуляции «второго удара», необходимого для развития АФС. Более того, предполагается, что сосудистые и гормональные изменения во время беременности напоминают «второй удар».
Положительный результат на антитела к β2GP1 имеет большое значение для оценки акушерского риска у АФА-положительных пациенток. Неблагоприятные исходы беременности более тесно связаны с анти-β2GP1 антителами, чем с антикардиолипиновыми или волчаночным антикоагулянтом. Исследование PREGNANTS, включавшее беременных женщин с АФС, получавших традиционное лечение, продемонстрировало, что у пациенток, имеющих только положительный результат на aнти-β2GP1, наблюдалась более высокая частота таких заболеваний беременных, как преэклампсия, задержка роста плода, преждевременные роды и мертворождение, а также более низкий уровень живорождений, чем у пациенток с положительным результатом только для аCL или LA. Эти данные подтверждались и с помощью алгоритма EUREKA, инструмента для определения величины акушерского риска, включая любой титр АФА (диагностический или нет) [11].
Аннексин А5 (AnxA5)
Аннексин А5 действует как физиологический антикоагулянт, образуя щит на поверхности клетки и предотвращает активацию свёртывания крови [9]. Антитела могут нарушать этот щит и предрасполагать к тромбозу.
Тест устойчивости к аннексину А5 (A5R) – анализ на основе измерения времени свёртывания крови с добавлением аннексина A5. У пациентов с положительными антителами к aPL время свертывания крови значительно короче. Устойчивость к антикоагулянтной активности AnxA5 связана с распознаванием антителами β2-гликопротеина I и определяет подгруппу женщин с акушерским АФС.
В одном исследовании на 750 пациентках с тромбозами и осложнениями беременности авторы обнаружили снижение соотношения антикоагулянтов А5 у пациентов с положительными АФА с тромбозом и/или осложнениями беременности по сравнению с пациентами с отрицательными АФА. Это может выявить пациентов со склонностью к тромбозам или осложнениям беременности [26].
Работа системы комплемента и связь ее с аутоиммунной патологией
Система комплемента – это комплекс белков иммунной системы, обеспечивающих защиту клеток организма от чужеродных агентов. Белки последовательно (каскадом) активируют друг друга, что обеспечивает лучшую регуляцию, более высокую надежность и усиление сигнала.
Выделяют три основных варианта активации этой системы: классический, альтернативный и лектиновый пути.
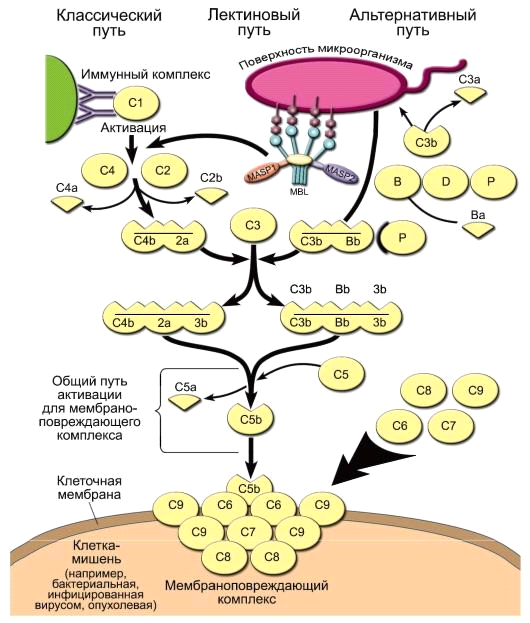
При классическом пути первыми в ответ на внедрение антигена образуются специфические антитела, которые активируют систему комплемента. Это более молодой путь активации системы комплемента.
При альтернативном пути система комплемента активируется за счет взаимодействия с веществами, которые находятся на поверхности клеток микроорганизмов. Это более старый путь и он не требует участия антител.
В итоге классический и альтернативный приходят к одному общему пути. Его результатом является образование на клетке-активаторе канала, через который входит вода. Клетка набухает, лопается и гибнет.
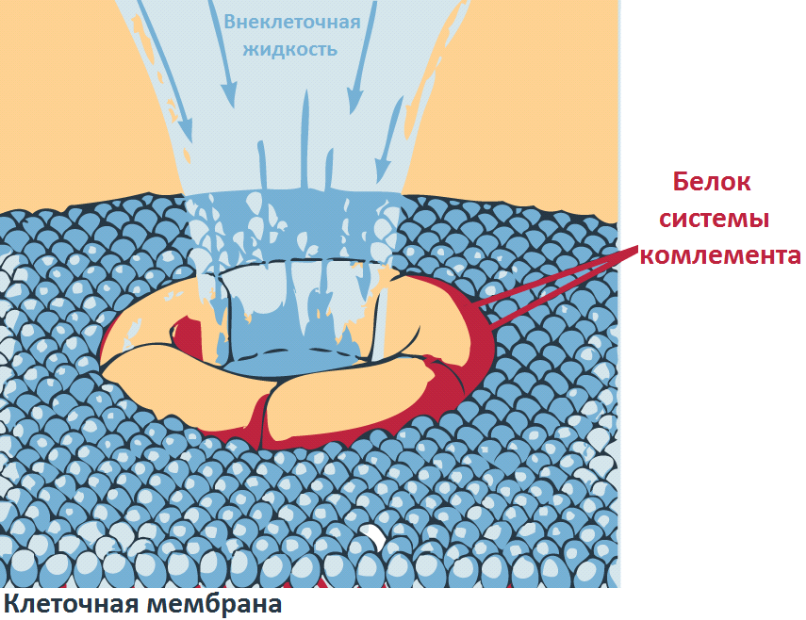
В норме с помощью системы комплемента организм борется в норме с теми клетками, которые заражены вирусами, бактериями, с раковыми клетками. Наличие аутоантител может приводить к активации системы комплемента против собственных клеток, вызывая воспалительный процесс и активацию свёртывания крови.
При активации системы комплемента уровни его компонентов снижаются. Некоторые клинические исследования показали низкие уровни C3 и C4 в качестве независимых предсказателей более низкого веса при рождении новорожденных и преждевременных родов, а более высокие уровни компонента C3 в сыворотке в первом гестационном триместре были защитным фактором.
Гены, предрасполагающие к антифосфолипидному синдрому и аутоиммунным заболеваниям. HLA гены.
Аутоиммунная реакция организма на свои же клетки опосредована теми генами, которые определяют способности и возможности иммунной системы человека. У разных людей эта реакция будет отличаться.
Один из важнейших факторов развития АФС – определенные варианты генов гистосовместимости HLA. Блоки генов гистосовместимости предоставляют иммунной системе белки, которые вырабатываются по этим генам, и которые представлены на каждой клетке в нашем организме. Именно они настраивают иммунную систему на определенную работу.
В репродукции используется анализ генов HLA 1 и 2 класса. 1 класса – А, В и С. 2 класса – DRB1, DQA1, DQB1. У каждого человека по 2 варианта каждого из этих генов (один вариант от отца, второй от матери). Эти гены находятся близко друг к другу на хромосоме, поэтому наследуются вместе. Варианты генов HLA объединяются в группы вариантов, образуя так называемые гаплотипы – устойчивые сочетания генов.
Гаплотипы, предрасполагающие к развитию аутоиммунных заболеваний
DR7-DQ2.2. – самый древний гаплотип, который есть у человечества. Является сильным вариантом, который предрасполагает к антифосфолипидному синдрому.
DR7-DQ9, DR3-DQ2.5, DR4-DQ7.3, DR4-DQ8.1, DR4-DQ4.3. Из них DR3 и DR4 – сильные факторы, которые предрасполагают к аутоиммунным заболеваниям, к сахарному диабету первого типа.
DR4 – повышает риск развития ревматоидного артрита.
DQ2.5, и DQ2.2, и DQ9, и DQ8 – это аллели, которые предрасполагают к непереносимости злаков.
Специалисты Центра иммунологии и репродукции оценивают эти конфигурации по анализу на HLA. Это сильный фактор, на который можно воздействовать, снижая количество аутоиммунных антител, в том числе антител, которые характеризуют антифосфолипидный синдром. Особенно это важно при планировании беременности.
Кому показано обследование на АФС?
Обследование на наличие АФС показано пациентам в анамнезе которых встречаются:
- Тромбозы
- Невынашивание беременности
- Антенатальная гибель плода
- Преэклампсия
- Преждевременная отслойка нормально расположенной плаценты (ПОНРП)
- Внутриутробная задержка роста плода (FGR)
- Аутоиммунные заболевания, в частности, системная красная волчанка. Около 40% пациентов с СКВ имеют АФС. Более того, было подсчитано, что АФС может развиться у 50-70% пациентов с СКВ и положительными АФА после 20 лет наблюдения [4].
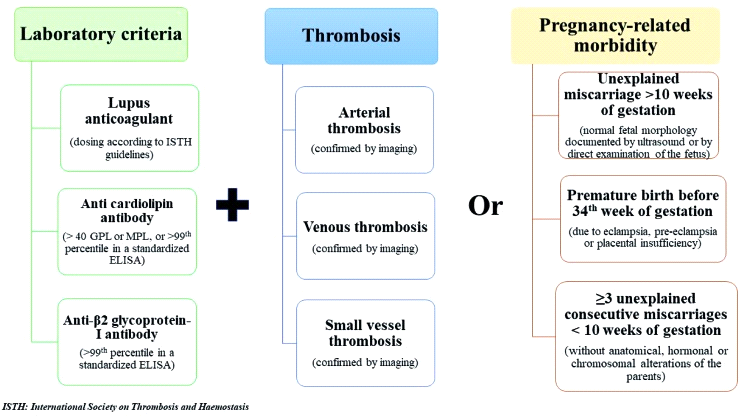
Классические критерии антифосфолипидного синдрома
Постановка диагноза антифосфолипидный синдром основана на сочетании определенных клинических и лабораторных признаков, впервые сформулированных в 1998 году в Саппоро и пересмотренных в 2006 году в Сиднее [13].
 [26]
[26]
Лабораторные критерии АФС
Классическими лабораторными критериями АФС являются:
- обнаружение волчаночного антикоагулянта (ВА, lupus aticoagulant, LA);
- антикардиолипиновых антител IgG/IgM (АКЛ, aCL) с титрами >40 GPL или MPL или >99-го процентиля или антител против β2-гликопротеина-1 (aβ2GPI) IgG/IgM с титрами> 40 AU или >99-го процентиля.
- Для постановки диагноза классического АФС положительный результат хотя бы по одному из упомянутых параметров должен быть обнаружен не менее двух раз с интервалом в 12 недель.
Волчаночный антикоагулянт
Волчаночный антикоагулянт – это важнейший тест для диагностики АФС. Под волчаночным антикоагулянтом понимают группу антител, наличие которой определяется специальным методом, основанным на времени свёртывания крови. Измерение волчаночного антикоагулянта традиционно состоит из трехэтапной процедуры: скрининг, смешивание (микс-тест) и подтверждение.
I. На первом этапе выполняется два скрининговых теста: тест с разведенным ядом гадюки Рассела (dRVVT) и чувствительное к волчаночному антикоагулянту активированное частичное тромбопластиновое время (АЧТВ, чувствительное к ВА). Оба анализа дополняют друг друга, поскольку антифосфолипидные антитела не всегда реагируют в обеих тест-системах. В нашей лаборатории оба теста выполняются одновременно.
Анализ dRVVT основан на прямой активации X фактора свертывания ферментом, присутствующим в яде гадюк Рассела. Антифосфолипидные антитела в плазме пациента будут реагировать с фосфолипидными компонентами реагента и продлевать время свертывания за счет снижения активности комплекса активатора протромбина.
Анализ АЧТВ основан на активации контактного (внутреннего) пути. Аналогично анализу dRVVT, антифосфолипидные антитела ингибируют фосфолипид-зависимые этапы пути коагуляции АЧТВ, увеличивая время свертывания.
Время свёртывания крови в обоих тестах измеряется в секундах. Чтобы корректно оценить результат пациента, выражение результатов анализа выдаётся в виде скринингового отношения (СО) путем деления результата времени свертывания крови пациента на результат нормальной плазмы (PNP).
Поскольку дефицит каких-то факторов или ингибиторы, могут привести к положительному результату скринингового анализа, за ним должны последовать этапы смешивания и подтверждения положительных результатов.
II. На этапе смешивания к плазме пациента добавляют нормальную плазму в соотношении 1:1. Добавляя плазму, мы добавляем и факторы свёртывания крови. Если проблема в их дефиците, она корректируется.
III. На подтверждающем этапе к тестируемому реагенту добавляется избыток анионного фосфолипида, который нейтрализует действие антител и время свёртывания приходит в норму. Анализ выдаётся в виде подтверждающего отношения (ПО).
Чтобы рассчитать, насколько значимо изменилось время в подтверждающем тесте, используют нормализованное отношение (НО): СО/ПО.
Факторы, влияющие на результат анализа на волчаночный антикоагулянт
- Воспалительный процесс и повышенный С-реактивный белок могут привести к ложноположительным результатам теста.
- Повышенная активность фактора VIII (FVIII) связана с более коротким временем свертывания АЧТВ и может привести к ложноотрицательным результатам скрининговых анализов АЧТВ, чувствительного к ВА. Можно наблюдать во время беременности, хирургических операций, воспалений, злокачественных новообразований и других состояний.
- Присутствие волчаночного антикоагулянта при инфекционных заболеваниях обычно является преходящим и не сопровождается клиническими проявлениямиё АФС.
- Некоторые лекарства (например, антибиотики, антиаритмические средства и хлорпромазин) и в меньшей степени вакцины (например, против вируса гепатита В).
- Антикоагулянтное лечение усложняет тестирование и интерпретацию волчаночного антикоагулянта, продлевая АЧТВ и dRVVT.
- Антагонисты витамина К вызывают удлинение АЧТВ и dRVVT за счет продукции неполных факторов свертывания крови.
- Нефракционированный гепарин, низкомолекулярный гепарин и гепариноиды в основном мешают, косвенно ингибируя действие тромбина и фактора Xa. Большинство реагентов dRVVT и некоторые реагенты АЧТВ содержат нейтрализующие гепарин агенты.
- Пероральные антикоагулянты напрямую ингибируют тромбин (например, дабигатран) или фактор Xa (например, апиксабан, бетриксабан, эдоксабан и ривароксабан), оказывая различное влияние на тесты на коагуляцию, даже на минимальных уровнях, что приводит как к ложноотрицательным, так и к ложноположительным результатам анализов на волчаночный антикоагулянт.
Вариабельность результатов анализа на антитела
Анализы, используемые для обнаружения АФА основаны на принципе иммуноанализа. Большое разнообразие методов анализа, реагентов и калибраторов приводит к высокой вариабельности. Для мониторинга рекомендуется проводить последующее тестирование пациентов в одной и той же лаборатории.
С другой стороны, когда результаты АФА отрицательны у пациентов с высоким клиническим подозрением на АФС, можно рассмотреть возможность повторного тестирования в другой лаборатории, используя другую платформу или анализ.
Классификация пациентов по лабораторным критериям
По лабораторным критериям рекомендуется классифицировать пациентов с АФС в одну из следующих категорий:
I. Присутствует более одного лабораторного критерия (любая комбинация);
IIа. присутствует только ВА;
IIб. присутствуют антикардиолипины;
IIв. присутствуют антитела против бета2-гликопротеина-1.
Клинические критерии АФС
Клиническими факторами постановки диагноза сосудистого антифосфолипидного синдрома являются:
- Один или более клинических эпизодов артериального, венозного тромбоза, или тромбоза сосудов малого диаметра, в любой ткани или органе.
- Тромбоз должен быть подтвержден воспроизведением изображения или допплеровским исследованием, или данными гистологического исследования, за исключением поверхностных венозных тромбозов.
- Морфологическое подтверждение должно быть представлено изменениями сосудистой стенки без наличия значительного воспаления.
При акушерском антифосфолипидном синдроме клиническими признаками для постановки диагноза являются:
- Три и более потери беременности на ранних сроках подряд без иных причин.
- Одна потеря беременности на сроке более 10 недель.
- Одни или более преждевременных родов на сроке до 34 недель в связи с преэклампсией или плацентарной недостаточностью.
Согласно европейскому регистру акушерского антифосфолипидного синдрома (EUROAPS) в группе из 1000 женщин с акушерским АФС наиболее распространенными акушерскими осложнениями были:
- привычные выкидыши (38,6%);
- потеря плода на сроке больше 10 недель (25,3%);
- недоношенность (28,5%);
- мертворождение (23%);
- преэклампсия с ранним началом 18,1% всех случаев; с поздним началом у 4,6% [14].
Некритериальные проявления акушерского АФС
Критерии были установлены в 2009 году и на сегодняшний день требуют пересмотра.
Некритериальные клинические проявления акушерского АФС
Экспертами принято выделять некоторые некритериальные проявления акушерского антифосфолипидного синдрома:
- два необъяснимых выкидыша (до 10-й недели беременности);
- три непоследовательных необъяснимых выкидыша (до 10-й недели беременности);
- отслойка плаценты и поздние преждевременные роды (до 34-й недели беременности);
- преэклампсия/эклампсия после 34 недель беременности (преэклампсия с поздним началом);
- преждевременные роды после 34 недель беременности (поздние преждевременные роды);
- преждевременная отслойка нормально расположенной плаценты на поздних сроках беременности на фоне какого-то события-триггера или же без него;
- преждевременный разрыв плодных оболочек;
- необъяснимая повторная неудача имплантации при оплодотворени in vitro (неудачный перенос как минимум 3 эмбрионов хорошего качества).
Таким образом, акушерский АФС может проявляться различными симптомами на любом сроке беременности [3,8].
В ряде случаев при наличии антифосфолипидных антител из-за повреждения сосудов или фолликулов происходит истощение функции яичников и преждевременное снижение овариального резерва, что может проявляться длительным ненаступлением беременности [15].
Привычное невынашивание беременности на ранних сроках является наиболее частым акушерским осложнением, связанным с АФС (38,6%). Атакуя клетки трофобласта, антифосфолипидные антитела препятствуют имплантации и развитию оплодотворенной яйцеклетки.
Большинство экспертов считают, что внутриутробная гибель плода и мертворождение являются специфическими клиническими особенностями АФС (антенатальная гибель плода определяется как потеря беременности после 10 недель беременности, мертворождение означает потерю беременности после 20 недель). Ряд исследований показали увеличение риска мертворождения в 3-5 раз при повышенных уровнях антифосфолипидных антител [16,17].
Преэклампсия осложняет около 10–17% беременностей с АФС. Преэклампсию диагностируют на основании нового появления гипертензии, протеинурии, поражения органов-мишеней после 20 недели беременности. Она проявляется в двух разных фенотипах, в зависимости от появления симптомов. Преэклампсия с ранним началом (EOP) происходит до 34 недель беременности, а с поздним началом (LOP) после 34 недель беременности. Преэклампсия с ранним началом обычно ассоциируется с задержкой роста плода и считается более «тяжелой» формой, тогда как с поздним началом обычно характеризуется исключительно материнскими проявлениями и имеет проявления от легкой до умеренной степени.
Задержка внутриутробного развития встречается примерно в 2–8% первых беременностей, тогда как тяжелая преэклампсия встречается в 0,5% беременностей в развитых странах. Задержку роста плода (ЗРП) обычно определяют как расчетную массу плода (EFW) или окружность живота (AC) меньше 10-го процентиля для гестационного возраста [19].
Большинство проспективных и ретроспективных наблюдательных исследований подтверждают связь высоких титров антифосфолипидных антител с преэклампсией и плацентарной недостаточностью. Данные показали, что у 50% беременных пациенток у которых наблюдалась преэклампсия или задержка развития плода (ЗРП) в анамнезе были обнаружены АФА. В это же время у здоровых беременных женщин АФА наблюдались у 7% и менее пациенток. В другом исследовании показано, что среди женщин, родивших с тяжелой преэклампсией или плацентарной недостаточностью >10% случаев были положительными на АФА по сравнению с <2% в контрольной группе. Ранняя преэклампсия и ранняя задержка роста наблюдались у 181 (18,1%) и 161 (16,1%) пациентки соответственно.
Женщины с АФС подвергаются повышенному риску преждевременных родов [18].
Лабораторные некритериальные проявления. Серонегативный АФС.
Иногда клиническая картина наводит на мысль об АФС, но анализы по классическим антифосфолипидным антителам постоянно отрицательны. Такая ситуация носит название серонегативный АФС (SN-APS).
Причины появления серонегативного варианта:
- изменчивость антифосфолипидных антител из-за терапии препаратами гепарина, преднизона или гидроксихлорохина;
- беременность может вызвать колебания, снижение или падение титров антифосфолипидных антител [31];
- до 50% женщин с акушерским АФС могут иметь более низкие ACL и/или Aβ2GPI в отсутствие LA по сравнению с женщинами с тромботическим АФС [32];
- использование различных тестов для проведения анализов.
Публикации последних лет показывают значимость так называемых некритериальных антител и низкого титра критериальных антител.
К некритериальным лабораторным критериям относятся:
- низкий титр антикардиолипиновых антител IgG/IgM (между 95-м и 99-м процентилем)
- низкий титр антител IgG/IgM против гликопротеина I b2 (между 95-м и 99-м процентилем)
- периодическое появление антител IgG/IgM к кардиолипину и/или IgG/IgM к гликопротеину I b2 и/или волчаночного антикоагулянта, обнаруженных с интервалом 6–12 недель [22].
Могут присутствовать или обнаруживаться некритериальные антитела. Наиболее анализируемыми являются антитела против фосфатидилэтаноламина, фосфатидилсерина, фосфатидилинозитола, фосфатидной кислоты, комплекса виментин/кардиолипин, аннексина V, протромбина, протеина S и протеина С, плазминогена, антитромбина III.
Антитела к фосфатидилсерину ингибировали развитие и инвазию трофобласта, снижали уровни ХГЧ и замедляли образование синцитиотрофобласта.
В одном исследовании с участием 866 женщин с привычным невынашиванием беременности (ПНБ) авторы обнаружили, что 87 из 866 женщин с отрицательным результатом на антитела к кардиолипину имели положительный результат на один из других видов АФА.
Во втором исследовании с участием 872 женщин с ПНБ 49 (3,6%) были отрицательными как на антитела к кардиолипину, так и на волчаночный антикоагулянт, но положительными антитела к фосфатидилсерину (ФС). В этом исследовании наличие антител к ФС имело положительную корреляцию с количеством последовательных потерь беременности.
В одной из публикаций были проанализированы осложнения как у пациенток с классическим акушерским АФС так и у пациенток при низком титре или некритериальных антителах. У первой группы пациенток наиболее частым осложнением была недоношенность (24,1%), тогда как у пациенток второй группы наиболее частым осложнением был выкидыш (19,4%). Наличие как критериальных, как и некритериальных антител может приводить к неблагополучным акушерским исходам.
Лечение в группе серонегативных женщин снижает частоту осложнений беременности [9].
Иммуноглобулины A
Помимо антител классов IgG и IgM при антифосфолипидном синдроме вырабатываются антитела класса IgA и в некоторых случаях только они свидетельствуют об АФС как о причине грозных осложнений.
Иммуноглобулины А рекомендуется исследовать в том случае, если клиническое подозрение на антифосфолипидный синдром очень велико, а других иммуноглобулинов не обнаружено. В нашей практике мы назначаем полное обследование сразу, как как исследования показывают, что антикардиолипины и/или антитела к бета-2-гликопротеину-1 IgA связаны с тромбозами и заболеваемостью беременных [23,24,25].
Антитела трех классов (IgG, IgA, IgM) к кардиолипину и бета-2-гликопротеину так же анализируются суммарно, чтобы расширить зону поиска при диагностике акушерского АФС.
Профили пациентов с несоответствием критериям АФС
Многие пациенты не полностью соответствуют клиническим и лабораторным критериям. Случаи с неполными клиническими или лабораторными данными классифицируются как акушерские осложнения, связанные с АФС (OMAPS) и некритериальный акушерский АФС (NC-OAPS) соответственно [8].
В докладе 14-ого Международного конгресса по антифосфолипидным антителам подчеркивалась роль определенных «некритериальных» клинических проявлений заболевания, устанавливая путь для возможного включения их в рамках критерия [27]. Более того, рекомендации EULAR 2019 для лечения антифосфолипидного синдрома у взрослых включали некоторые выводы по лечению клинических «некритериальных» акушерских АФС [28]. Растущие данные свидетельствуют о том, что несколько серонегативных по лабораторным критериям пациентов являются результатом ограничения рассматриваемых антител, и что тестирование на «некритериальные» антифосфолипидные антитела (АФА) может улучшить диагностику АФС [29].
Установлено четыре потенциальных профиля пациентов, сгруппированных под широким термином «некритериальный АФС»:
- Серонегативный АФС: пациенты, соответствующие клиническим критериям плюс «некритериальные» проявления, со стойко отрицательными антифосфолипидными антителами.
- Клинический некритериальный АФС: пациенты с «некритериальными» проявлениями плюс положительный результат по антифосфолипидным антителам, отвечающий критериям классификации;
- Неполный лабораторный АФС: пациенты, соответствующие клиническим критериям плюс положительные антифосфолипидные антитела, но не соответствующие критериям классификации (низкий титр АФС);
- Лабораторный некритериальный АФС: пациенты, соответствующие клиническим критериям, с отрицательным или низким титром критерия АФА, плюс положительный «некритериальный» АФА.
Такая категоризация могла бы обеспечить более однородный исследовательский подход к АФС, что позволило бы сделать более обоснованные и универсальные выводы [30].
Блок аутоантител
В нашей лаборатории есть специальный комплекс тестов, который называется «Блок аутоантител». Туда входят классические антитела и некритериальные антитела, значимые для акушерства: антитела к аннексину V, антитела класса IgA к бета-2-гликопротеину - 1 и кардиолипинам, а также антитела против ДНК и факторов щитовидной железы.
Другие показатели крови при АФС
Некоторые отклонения лабораторных показателей также имеют потенциальное диагностическое значение при наличии тромбоэмболических явлений и акушерских заболеваний.
Тромбоцитопения
При антифосфолипидном синдроме снижается количество тромбоцитов (тромбоцитопения), потому что у них точно также есть мембрана, и эти антифосфолипидные антитела могут ее повреждать. Поврежденные тромбоциты и эритроциты, проходя через печень, через селезенку, сильнее разрушаются. Эксперты предлагают вернуть тромбоцитопению в критерии АФС.
Удлинение АЧТВ
В коагулограмме при АФС может наблюдаться удлинение показателя АЧТВ (активированное частичное тромбопластиновое время).
Удлинение АЧТВ может быть связано с двумя группами причин:
- наличие ингибиторов свёртывания крови (в том числе, антифосфолипидных антител и волчаночного антикоагулянта), при котором сгустку мешают образоваться другие вещества;
- дефицит факторов свертывания крови, при котором веществ для реакций свёртывания недостаточно.
При удлинении АЧТВ проводится тест смешивания с нормальной плазмой. В плазму крови вводится другая плазма условно здорового человека и анализ на АЧТВ повторяется. Если удлинение АЧТВ было связано с недостатком факторов, то добавление плазмы условно здорового человека этот дефект убирает, и АЧТВ становится нормальным.
Если причиной растягивания АЧТВ было наличие антифосфолипидных антител, то добавление плазмы условно здорового человека практически никак не меняет этот показатель.
Проявления АФС вне беременности
Международной целевой группой были проанализированы следующие некритериальные клинические проявления АФС: тромбоз поверхностных вен, тромбоцитопения, почечная микроангиопатия, поражение сердечного клапана, сетчатое ливедо, мигрень, хорея, судороги и миелит, некроз костей, ускоренный атеросклероз. Результаты показали, что тромбоцитопению, АФС-нефропатию, поражение клапанов сердца, сетчатое ливедо, хорею, продольный миелит и серонегативный АФС рекомендуется включить в следующие пересмотренные критерии АФС [21].
Одним из некритериальных, но важных проявлений АФС является сетчатое ливедо, которое присутствует почти у четверти пациентов и может коррелировать с высоким риском тромбоза. Именно по этой причине эти клинические данные должны вызвать подозрение на наличие антифосфолипидного синдрома [5]. Однако сетчатое ливедо, симметричная пятнистость кожи, имеет низкую специфичность и часто встречается у здоровых людей, обычно вызываясь воздействием холода. Напротив, кистевидное ливедо, нарушенная асимметричная пятнистость кожи, более специфично для АФС. На фоне ливедоидной васкулопатии могут развиться кожный некроз или изъязвления [20].
Тромбоцитопения обычно легкая и наблюдается у 20–40% пациентов с АФС. Несмотря на низкое количество тромбоцитов, у пациентов с АФС сохраняется риск тромбоза. Кумбспозитивная аутоиммунная гемолитическая анемия также может развиваться менее чем у 5% пациентов с первичным АФС [20].
Антифосфолипидные антитела могут поражать всю почечную сосудистую сеть (т.е. артерии, артериолы и клубочковые капилляры), приводя к тромбозу крупных сосудов, а также к микрососудистым заболеваниям во внутрипочечных артериолярных и клубочковых капиллярах, что приводит к АФС-нефропатии [20].
Пороки клапанов сердца (вегетации и/или утолщение клапана) могут возникать у АФА-положительных пациентов [20].
У АФА-положительных пациентов могут развиваться неврологические нарушения, особенно в виде когнитивной дисфункции [20].
Оценка тромботического и акушерского риска
Беременность представляет собой протромботическое состояние, обусловленное физиологическими изменениями в организме. Следовательно, беременность формирует дополнительный фактор риска тромбоза у пациентов с АФС: каждое четвертое тромботическое событие при АФС связано с беременностью. Абсолютный риск тромбоза во время беременности и в послеродовом периоде составляет по разным оценкам от 1 до 12%.
Риск дополнительно определяется профилем антител пациента.
Положительный результат на волчаночный антикоагулянт, тройной положительный результат на критериальные антифосфолипидные антитела (лабораторная категория I) считаются профилем высокого риска. Недавний систематический обзор и метаанализ показали, что у пациентов с таким риском снижается вероятность живорождения и повышается риск рождения новорожденного с малым размером для гестационного возраста и преждевременных родов. Кроме того, у пациенток с положительным результатом на ВА наблюдался повышенный риск преэклампсии. Тромбоз в анамнезе также увеличивает риск нежелательных явлений во время беременности (снижение шансов живорождения, увеличением неонатальной смертности, повышенный риск антенатального или послеродового тромбоза и повышенным риском рождения новорожденного малым для срока беременности).
Другим важным фактором риска является предшествующий тромбоз, и традиционные факторы риска венозной тромбоэмболии (ВТЭ) также применимы к беременной пациентке с АФС.
Пациентки с чисто акушерским АФС также имеют повышенный риск будущих тромботических событий.
В одном исследовании у пациенток с привычным выкидышем частота тромботических событий составила 19,3% при среднем периоде наблюдения 7,3 года, при этом в группе с идиопатическим привычным выкидышем тромбозов не было. В другом исследовании «случай-контроль» у пациенток с акушерским АФС сообщалось о примерно удвоенном риске венозной тромбоэмболии по сравнению с идиопатическим контролем.
Беременность также может спровоцировать наиболее тяжелую форму синдрома, называемую катастрофическим АФС. Это крайне редкое проявление характеризуется мультиорганным тромбозом, часто в микроциркуляторном русле, возникающим в течение одной недели. Беременность является провоцирующим фактором примерно в 8 % случаев, половина из которых происходит во время беременности, а половина - после нее. В одной серии случаев как материнская, так и перинатальная смертность были высокими, около пятидесяти процентов.
АФА проникают через плаценту, и новорожденные от матерей с АФС могут иметь положительный результат теста на эти антитела. К счастью, это, по-видимому, не вызывает тромбоза у младенцев. Наблюдались нарушения развития нервной системы, но неясно, существует ли повышенный риск, не говоря уже о причинно-следственной связи [36].
Поскольку гиперкоагуляция у матери может продолжаться примерно до 12 недель после родов, рекомендуется продолжать прием гепарина после родов в профилактической дозе в течение 6–12 недель, чтобы снизить риск тромботических событий у матерей с акушерским АФС. Кроме того, что касается долгосрочного наблюдения, первичная тромбопрофилактика у пациенток с акушерским АФС без тромбозов в анамнезе может быть целесообразна, поскольку эти пациенты имеют более высокий риск тромбоза [10].
Первым шагом в оценке тромботического риска у пациентов с АФС является характеристика антител и оценка сердечно-сосудистых факторов риска. Таким образом, риск тромбоза варьируется в зависимости от положительного результата на АФА и титров антител.
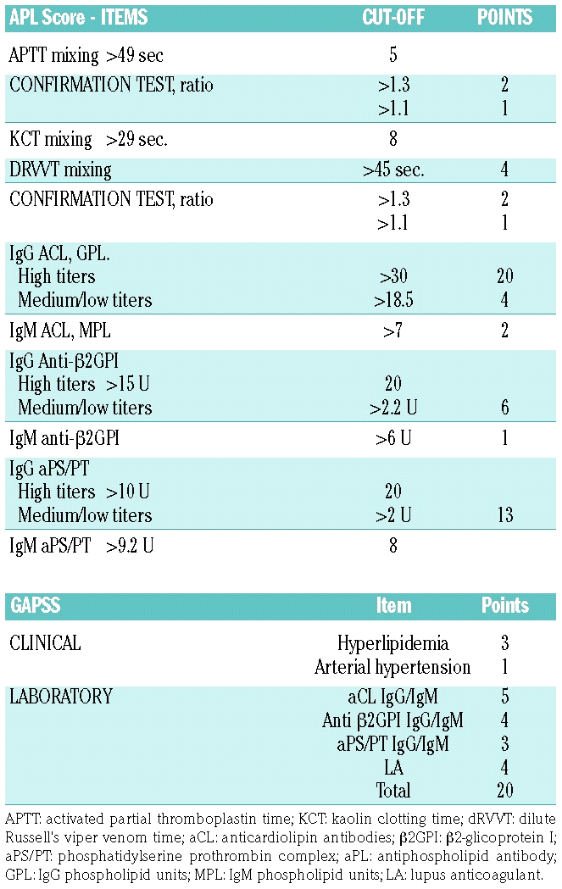
Эксперты рекомендуют использовать профилактические стратегии и план мониторинга. Посещения и анализы крови следует проводить не реже одного раза в месяц, дополнительное ультразвуковое измерение биометрических и допплеровских данных для диагностики задержки внутриутробного развития плода и оценки риска преждевременных родов. Следует регулярно проводить мониторинг артериального давления и суточное исследование мочи на протеинурию.
Стратификация тромботического риска является более сложной задачей у пациентов с некритериальными антителами, которые, по-видимому, связаны с различными тромботическими осложнениями. Так, АФС/ПТ и антитела к комплексу виментин/КЛ повышают риск артериального тромбоза, а осложнения беременности связаны с наличием антител к фосфатидилэтаноламину, ПА, ФС и ПИ [26].

Профилактика и лечение АФС
Тщательный сбор анамнеза пациентки помогает заподозрить и выявить АФС. Важно выявить наличие кожных, суставных, других аутоиммунных заболеваний (например, хронического аутоиммунного тиреоидита, антител к щитовидной железе). Были ли какие-то аутоиммунные нарушения (суставные, псориаз, витилиго, экземы и т.д) у родственниц по женской линии, как проходила их беременность и роды. Это всё имеет большое значение, потому что генетическая предрасположенность к аутоиммунным нарушениям может у каждого человека реализовываться по-своему, за счет влияния разных наборов генов, разных внешних факторов. На АФС влияет и вес человека, курение, глюкоза, которая блокирует белки, повышенное артериальное давление. Есть множество дополнительных факторов, которые важно учитывать при сборе анамнеза.
Отличие терапии акушерского АФС и васкулярного АФС
При сосудистом АФС основным фактором является образование тромбов. Поэтому очевидная терапия – антикоагулянтная, то есть лекарства, которые препятствуют свёртыванию крови.
Акушерский антифосфолипидный синдром далеко не всегда сопровождается образованием тромбов. В этом случае повреждаются клетки плаценты, клетки трофобласта. Поэтому терапия акушерского антифосфолипидного синдрома должна быть направлена не столько на предотвращение образования тромбов, сколько на защиту клеток трофобласта и клеток плаценты от действия антител.
Методы лечения акушерского АФС сосредоточены на следующих аспектах:
- улучшение плацентации;
- снижение действия антител;
- снижение активации комплемента;
- предотвращение тромбоза [3,33].
Какие препараты могут быть использованы?
- Аспирин
- Гидроксихлорохин (Плаквенил)
- Иммуноглобулины
- Гепарин
- Метипред
Схема лечения подбирается индивидуально для каждой пациентки, а группы препаратов нельзя заменять друг на друга, так как они воздействуют на разные звенья патогенеза акушерского антифосфолипидного синдрома. Также важно учитывать эффективность применяемых средств и их побочное действие.
Аспирин и гепарин
Препараты аспирина рекомендованы как базовые препараты терапии АФС с момента планирования беременности и в первом триместре на этапе формирования плаценты. Важно защитить плаценту от повреждений именно в этот период, когда еще есть возможность влиять на ее развитие. Это безопасный и эффективный способ профилактики осложнений беременности.
В большинстве исследований лечение аспирином начиналось до зачатия и продолжалось до 36 недель беременности или до доношенной беременности, а прием препаратов низкомолекулярного гепарина или нефракционированного гепарина начинался после подтверждения беременности. Учитывая неоднородность протоколов лечения, невозможно дать рекомендации по оптимальному времени начала и продолжительности лечения [34].
Данные Жирарди показали, что гепарины предотвращают акушерские осложнения у женщин с АФС, потому что они блокируют активацию комплемента, индуцированную антифосфолипидными антителами [12].
Но даже при такой схеме, которая раньше казалась достаточной, всё равно были женщины (20-30 % случаев), на которых это не работало: возникали потери беременностей, в том числе на больших сроках. Такой вариант течения АФС называется рефрактерным, или нечувствительным [35].
Гидроксихлорохин
Новые клинические рекомендации по антифосфолипидному синдрому рассматривают гидроксихлорохин (плаквенил) в качестве терапии при рефрактерном АФС. Плаквенил не дает системе комплемента повреждать свои же клетки, действует очень мягко и практически не дает побочных эффектов. Плаквенил применяется уже более 25 лет не только при терапии АФС, но и при других аутоиммунных патологиях (при наличии антинуклеарных антител, или других иммунных факторов, которые могут повреждать эмбрион на ранних сроках).
Несколько исследований предоставили доказательства, подтверждающие безопасность гидроксихлорохина во время беременности.
Положительный эффект при лечении АФС и уменьшении преэклампсии с помощью гидроксихлорохина был показан в нескольких исследованиях.
Три ретроспективных исследования связали гидроксихлорохин с увеличением числа живорождений у пациентов с АФС.
Также было показано, что гидроксихлорохин снижает частоту тромбозов у пациентов с первичным АФС (ПАФС).
Более того, использование гидроксихлорохина также было связано со снижением уровня IgG к антикардиолипину, IgG/IgM к анти-β2-гликопротеину и уровня интерферона I типа у пациентов с первичным АФС [18].
Механизмы действия гидроксихлорохина
Гидроксихлорохин может модулировать кислотность лизосом, вызывая нарушение презентации антигенов и иммунный ответ, ингибирует активацию комплемента, снижает выработку тканевого фактора (ТФ), разрушает связывание aβ2GP1 с β2GP1 и комплексами фосфолипидных бислоев, ингибирует выработку фактора некроза опухоли α (TNFα) в моноцитах, восстанавливает антикоагулянтное действие аннексина V, уменьшает изменения трофобласта, гибель плода, плацентарную недостаточность, тромбозы, эндотелиальную дисфункцию и снижение уровня волчаночного антикоагулянта, восстанавливает эндотелиальную функцию в клетках у женщин с рефрактерным первичным акушерским АФС [35].
На конгрессе весной 2022 года профессор Мирони из Италии, на вопрос: «Назначаете ли Вы гидроксихлорохин?», ответил: «Да. При постановке диагноза антифосфолипидного синдрома Плаквенил назначается обязательно, потому что именно он защищает клетки от повреждений системой комплемента».
Ведение беременности с АФС
Беременность с АФС относится к категории высокого риска. Наблюдение ведётся по принципу «Плацента клиник» с акцентом на гемостаз и аутоиммунные процессы, постоянно проводится мониторинг функции плаценты и состояния плода. Обязательно оцениваются коагулограмма и тромбоэластограмма, как при планировании беременности, так и при положительном тесте, и дальше в течение беременности необходимо смотреть результаты по свертыванию крови, есть или нет необходимость препарата - гепарина.
Есть еще много факторов, которые оказывают влияние - это и анамнез женщины, и наследственный анамнез (какие заболевания были у родственников), это комбинация генов свертывания крови, комбинация генов, которые влияют на сосудистые спазмы, виды выявленных аутоантител. Результаты данных исследований влияют на то, какая будет назначена схема лечения, схема поддержки, схема профилактики этих нарушений. Она подбирается всегда индивидуально.
Оценка агрегации тромбоцитов также является важным тестом, так как тромбоцитарная стенка является площадкой для активации свертывания крови, она участвует и в иммунных реакциях тоже. И даже если есть какие-то другие проблемы со свертыванием крови, все равно назначается препарат ацетилсалициловой кислоты. Его доза может быть разной, в зависимости от генов свертывания крови и комбинации тромбоцитарных генов.
Особенности жизни пациенток с АФС
Контрацепция
Женщинам с СКВ и/или АФС проводится подбор контрацепции, особенно для предотвращения нежелательной беременности в периоды высокой активности заболевания и при приеме тератогенных препаратов. Также следует внимательно следить за наличием таких факторов риска, как гипертония, ожирение, курение, семейный анамнез гормонально-зависимых видов рака.
Когда речь идет о женщинах с положительным уровнем АФА и использовании комбинированных гормональных контрацептивов, таких как пероральные таблетки, вагинальные кольца или трансдермальные пластыри, следует принять некоторые меры предосторожности. Использование этих методов контрацепции не рекомендуется не только у пациенток с АФС, но и у женщин с положительными антителами.
Женщины с профилем низкого риска, но принимающие антикоагулянты, используют эстрогены для лечения гинекологических заболеваний, которые нельзя лечить иначе. Им также могут быть полезны препараты, содержащие прогестин (таблетки, подкожные инъекции депо), но с осторожностью: их использование следует сопоставлять с риском тромбоза. Таблетки на основе прогестина для неотложной помощи не противопоказаны пациентам с СКВ и/или АФС [4].
Проблемы фертильности. ЭКО при АФС.
Проблемы могут возникнуть у женщин, которые используют иммунодепрессанты, такие как алкилирующие агенты (циклофосфамид), которые могут вызвать нарушения менструального цикла и даже привести к преждевременной недостаточности яичников.
Эффективность использования методов вспомогательной репродукции будет выше, если АФА-позитивным женщинам будет назначено соответствующее антитромботическое лечение. Специалисты рекомендуют такое же лечение, как и во время беременности, в зависимости от индивидуального профиля риска. Авторы также предлагают прекратить прием низких доз аспирина за три дня до забора яйцеклеток и возобновить его на следующий день, в то время как пациентам, принимающим НМГ, рекомендуется прекратить прием по крайней мере за 12 часов до процедуры и возобновить прием в тот же день (если кровотечения нет) [4].
Менопауза и заместительная гормональная терапия
Рекомендации предполагают, что использование заместительной гормональной терапии (ЗГТ) должно быть тщательно взвешено с учетом тромботических и сердечно-сосудистых рисков, когда речь идет о женщинах с АФС. Эти методы лечения следует назначать только на максимально короткий период времени и в том случае, если симптомы менопаузы достаточно серьезные [4].
Вакцинация против ВПЧ
Согласно рекомендациям EULAR по вакцинации взрослых пациентов с аутоиммунными воспалительными ревматическими заболеваниями, вакцинацию против ВПЧ следует делать только молодым женщинам со стабильной или неактивной СКВ и/или АФС, уделяя особое внимание женщинам с профилем АФА высокого риска.
Последствия АФС
Осложнения на ранних и поздних сроках беременности имеют пожизненные последствия для здоровья как матери, так и ребенка.
У матери повышен риск сердечно-сосудистых заболеваний, что было описано еще в 1964 году Эпштейном. По данным литературы, у 30% женщин с преэклампсией развивается артериальная гипертензия и у 25% — метаболический синдром. Сердечно-сосудистые изменения были обнаружены у женщин через 1 год после беременности с преэклампсией. Кроме того, преэклампсия связана с хроническими заболеваниями почек.
Также есть данные, что преэклампсия может привести к ухудшению качества жизни и увеличению риска послеродовой депрессии. Поэль и соавторы в своей работе 2009 г. выявили, что 20% всех женщин с преэклампсией нуждаются в психологическом лечении через несколько лет после родов.
Задержка развития плода ассоциируется с повышенным уровнем перинатальной заболеваемости и смертности. Различные авторы описали несколько осложнений, таких как гибель плода, перинатальная асфиксия, аспирация мекония, неонатальная гипогликемия и гипотермия, а также аномальное неврологическое развитие. Однако повышенный риск сердечно-сосудистых заболеваний и связанных с ними нарушений, гипертонии, инсульта и диабета 2 типа в более позднем возрасте также коррелирует с СЗР.
Преждевременные роды определяются как роды на сроке менее 37 недель беременности и являются важной причиной младенческой и детской заболеваемости и смертности, особенно если они происходят до 28 недель беременности. Примерно 65% преждевременных родов происходят из-за спонтанных преждевременных родов или преждевременного разрыва плодных оболочек; остальные по причинам со стороны матери и/или плода. Примерно две трети перинатальной смертности и половина долгосрочных неврологических нарушений, таких как церебральный паралич, связаны с преждевременными родами. Это также является причиной роста числа неинфекционных заболеваний, передаваемых из поколения в поколение [18].
Клинические случаи пациенток с АФС
Первый клинический случай: Первые проявления в период беременности
Дементьева С.Н.
Если же возникнет патология, не совместимая с нормальным развитием плода, беременность остановится.
История: Анна, 38 лет. Вес 58,2 кг. На фоне длительного бесплодия наступила беременность, но было она прервалась на раннем сроке. В анамнезе - резекция обоих яичников по поводу эндометриоидных кист. Антимюллеров гормон – 0,53, функция яичников снижена. Снижено количество андрогенов в крови. Принимала препарат для улучшения функции яичников.
В анамнезе хронический аутоиммунный тиреоидит, повышение антител к тиреоглобулину в 2018 году, снижение функции щитовидной железы (до беременности пациентка принимала препарат гормона щитовидной железы).
Склонность к повышению артериального давления до 130/85. Это фактор риска сосудистого спазма, который может негативно сказаться на формировании плаценты.
Анализы до беременности
При оценке генов сосудистого спазма обнаружена генетическая предрасположенность: гетерозиготы в гене CYP11B2 (альдостеронсинтаза), в гене ангиотензиногена (AGT), в синтазе оксида азота (NOS3). Из-за предрасположенности к повышению давления назначена диета с ограничением соли.
По генам, которые влияют на свертывание крови: гомозигота по ITGA2 (ген рецептора коллагена). Из генов, которые влияют на образование фибрина обнаружен ген гипофибринолиза – PAI-1 (SERPINE1) в гомозиготном состоянии 4G/4G. В гетерозиготе PLAT. При планировании был назначен препарат аспирина.
Среди генов цитокинов обнаружены гетерозиготные варианты, которые влияют на цитокиновый обмен. Соответственно, возможна активация по клеточному звену (интерлейкин-1, интерлейкин-18 и т.д.) и по гуморальному звену (две точки интерлейкина в гомозиготном состоянии).
Блок аутоантител: в норме. Антинуклеарные антитела: в норме.
Яичники работали слабо. M-эхо, например, было 6 мм. Было снижено количество эстрадиола и прогестерона во 2 фазу. Назначена терапия: препараты, которые улучшают рост яйцеклеток, имеющихся в яичнике. Беременность наступила самостоятельно.
Анализы после самостоятельно наступившей беременности
Компоненты комплемента по нижней границе нормы. Тромбоциты в норме (анализ был сдан на фоне приема Тромбо АСС 100 мг). Агрегация с коллагеном – 57. (снижена, но это норма на фоне приема аспирина).
Гемоглобин 139. У пациентки гетерозигота гена гемохроматоза, поэтому мы заранее смотрели гемоглобин, еще до беременности. Ранний срок беременности, достаточно высокий для женщины гемоглобин по верхней границе нормы для небеременных, при том, что эритроцитарные индексы не огромные.
В антинуклеарных антителах обнаружились сомнительные Scl-70, которые более характерны для склеродермии. Иногда они не специфичны, тем более обнаружены в небольших количествах. Могут присутствовать при других аутоиммунных нарушениях.
Блок аутоантител: обнаружены антитела IgM к бета-2-гликопротеину-1 (108,98 при норме 20). Остальные суммарные антитела Ig M достаточно низкие, в том числе, и к кардиолипину, и к бета-2-гликопротеину-1 - 6,43 при норме 0-10. К протромбину, тиреоглобулину, к тиреоидной пероксидазе в норме.
В иммунограмме T-хелперы/индукторы немного снижены. T-цитотоксические лимфоциты (T-киллеры) 275 при норме 300-800 – снижены. Активированные T-лимфоциты – 1,2 при норме 1,3-10. Снижены. Иммунорегуляторный индекс 2,1 – больше в верхнюю сторону, но в норме. Смещение иммунорегуляторного индекса к верхней границе свидетельствует о повышении активности гуморального звена и выработки антител.
По коагулограмме: протромбиновое время 13,5 – в норме; 95 – протромбин по Квику; МНО – 1,03, ближе к верхней границе, чем к нижней, что не говорит о повышении свертывания крови. АЧТВ – 35,7. Повышен, необходимо обратить на него внимание. Тромбиновое время – 17,9, норма. Фибриноген – 3. Изокоагуляция при том, что на 35,7 по АЧТВ мы внимание обратили. Антитромбин III – нормальный. Волчаночный антикоагулянт отрицательный.
В итоге у пациентки на раннем сроке беременности, практически сразу после овуляции, были обнаружено повышение антифосфолипидных антител.
Второй клинический случай: Повышенный вес, привычное невынашивание, рассеянный склероз в семейном анамнезе
Дементьева С.Н.
История: Пациентка Надежда. Из-за сниженного овариального резерва беременность наступала дольше, около 1-1,5 лет. В анамнезе несколько эпизодов невынашивания беременности на ранних сроках – 5-6 недель. У Надежды повышен вес, артериальное давление вне беременности, есть наследственная предрасположенность к аутоиммунным заболеваниям (в семье наблюдался рассеянный склероз).
В течение беременности отслеживали антифосфолипидные антитела. При наличии предрасположенности к аутоиммунным нарушениям антитела могут быть еще до беременности, могут проявляться во время беременности, могут только в начале. Поэтому важен контроль на всем протяжении беременности: при наступлении беременности, в 12 недель (если не нашли еще раньше), в 20 недель и в 28-30 недель. Третий триместр очень важен и опасен в плане отслойки нормально расположенной плаценты, если вдруг появятся антифосфолипидные антитела. С Надеждой определяли все эти показатели.
Беременность наступила, корректировали давление, Назначен приём препаратов аспирина и гепарина, потому что было повышение свертывания крови. В районе 24-26 недель пришел волчаночный антикоагулянт (43,4 при норме 31-44; АЧТВ 28-29) и стал расти. За 11 дней он повысился выше референса (50,1; АЧТВ 34,7). Как только повысился волчаночный антикоагулянт, начали прием Метипреда. При приеме с удвоенной силой контролировали уровни глюкозы и давления.
Позже у Надежды случился ковид. По анализам, волчаночный антикоагулянт – 37,9, и АЧТВ – 28,8. Женщина на антикоагулянтной, антиагрегантной терапии. Протромбиновое время, все индексы, фибриноген, D-димер : в норме.
Надежда очень сильно контролировала себя в плане диеты, в плане физической нагрузки. И с доступностью медицинской помощи, и с доступностью анализов в плане их стоимости были ограничения. Было сложно, но в итоге у Надежды родился здоровый, хороший малыш, мальчик.
В итоге у Надежды антифосфолипидные антитела появились на сроке 28-30 недель.
Ссылки на источники
- https://pubmed.ncbi.nlm.nih.gov/24461539/
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9966557/
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8836886/
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6709396/
- https://pubmed.ncbi.nlm.nih.gov/20822807/
- https://www.frontiersin.org/articles/10.3389/fimmu.2018.00969/full
- https://pubmed.ncbi.nlm.nih.gov/17631008/
- https://www.mdpi.com/2077-0383/11/3/675
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10604227/
- https://www.tandfonline.com/doi/full/10.1080/25785826.2021.1969116
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9285810/
- https://www.nature.com/articles/nm1121
- https://pubmed.ncbi.nlm.nih.gov/16420554/
- https://pubmed.ncbi.nlm.nih.gov/30772493
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10234248/
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5684877/
- https://www.sciencedirect.com/science/article/abs/pii/S0049384811006256
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10452741/
- https://pubmed.ncbi.nlm.nih.gov/32738107
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10481699/
- https://pubmed.ncbi.nlm.nih.gov/11953980/
- https://pubmed.ncbi.nlm.nih.gov/30616398/
- https://pubmed.ncbi.nlm.nih.gov/32696448/
- https://pubmed.ncbi.nlm.nih.gov/32085759/
- https://pubmed.ncbi.nlm.nih.gov/24651022/
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7049333/
- https://www.sciencedirect.com/science/article/abs/pii/S1568997215000038
- https://ard.bmj.com/content/annrheumdis/early/2019/05/14/annrheumdis-2019-215213.full.pdf
- https://sciencedirect.com/science/article/abs/pii/S1568997220302664
- https://pubmed.ncbi.nlm.nih.gov/33223008/
- https://www.sciencedirect.com/science/article/abs/pii/S0889857X05703148
- https://pubmed.ncbi.nlm.nih.gov/24847815/
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6709396/
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8252114/
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10796698/
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8921454/
- https://www.sciencedirect.com/science/article/abs/pii/S0002937811007472
- https://jamanetwork.com/journals/jamainternalmedicine/article-abstract/216487
- https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(10)60709-X/fulltext





Комментарии