Перевод подготовлен специалистом лаборатории ЦИР, врачом КДЛ, Бабкеевой Э.Р.
Toxoplasma gondii – повсеместно встречающееся паразитическое простейшее, заражающее людей при различных условиях. Чаще всего заражение паразитом происходит в детском и подростковом возрасте. В развитых странах с умеренным климатом за последние тридцать лет распространенность этой инфекции – токсоплазмоз у человека - снизилась до 10-50% взрослого населения (15-45 лет), демонстрирующих серологические признаки инфицирования. Гораздо более высокие (до 80%) проценты инфицирования наблюдаются в тропиках, в общинах, контактирующих с зараженной почвой, непроваренным мясом и нефильтрованной водой.
Как только происходит заражение, Toxoplasma gondii прячется в нервной и мышечной ткани, и элиминировать его становится невозможно. Исследования в Европе и Северной Америке предполагают, что большее количество иммунокомпетентных людей позволит ограничить распространение паразита и ассоциированное с ним поражение тканей, обеспечив сохранение паразита в спящей форме. Воспаление сетчатки и сосудистой оболочки (ретинохороидит) – наиболее частая перманентная манифестация токсоплазмозной инфекции. В Европе и Северной Америке такие поражения постепенно развиваются у 1% зараженных лиц.
За последние 15 лет были собраны свидетельства того, что в Латинской Америке клинические признаки инфекции куда более тяжелые, чем в других странах, вероятно, ввиду преобладания более вирулентных паразитических штаммов. Сравнение групп зараженных новорожденных в Европе и Бразилии показало, что поражения глаз у детей в Бразилии были более обширными и ведущими к нарушению зрения.
Когда женщина впервые заражается токсоплазмой во время беременности, инфекция может передаться плоду, приводя к врожденному токсоплазмозу и соответствующим поражениям нервной системы и глаз. Размножение Toxoplasma gondii и разрушения тканей в мозге плода могут появиться даже после начала иммунного ответа у матери, включая продукцию антител IgG.
Токсоплазма – облигатный внутриклеточный паразит, существующий в трех формах: ооциста, содержащейся только в кошачьих испражнениях (отсюда известно, что токсоплазмоз у кошек – опасное для человека заболевание), тахизоит (быстроделящаяся форма, наблюдающаяся в острой фазе инфекции) и брадизоит (медленно делящаяся форма, наблюдаемая в тканевых кистах). Во время первичной инфекции кошка может выделять из своего пищеварительного тракта миллионы ооцист ежедневно в течении 1-3 недель. Эти ооцисты становятся способны к инфицированию через 1-5 дней, и могут сохранять эту способность более одного года, особенно в теплом окружении. Кошки, как правило, после первичной инфекции приобретают иммунитет, таким образом, повторное инфицирование ооцистами маловероятно.
Считается, что в развитых странах с умеренным климатом основным источником заражения беременных женщин является непроваренное мясо, содержащее брадизоиты. Так же, одним из основных источников инфекции является контакт с ооцистами, находящимися в почве или воде, а также употребление в пищу загрязненных овощей и фруктов. Сельскохозяйственные животные (птицы, свиньи, овцы, козы) заражаются теми же путями, а от зараженных животных получают мясо, содержащее тканевые цисты.
Таким образом, токсоплазмоз у кошек – отнюдь не единственная причина, по которой опасный паразит может поселиться в человеческом теле.
Мать заражается токсоплазмозом оральным путем. Следствием токсоплазмоза при беременности становится инфицирование плода, которое происходит путем трансмиссии паразита через плаценту в результате первичного инфицирования матери. Вероятнее всего трансмиссия происходит во время паразитемии в первые дни после инфекции и до развития иммунного ответа. Риск заражения плода резко возрастает с увеличением гестационного срока.
Для своего существования и размножения тахизоиты проникают в клетки, особенно в мозговой и мышечной ткани, где формируют тканевые цисты, которые могут находиться в спящем состоянии годами. В иммунокомпетентных лабораторных моделях тканевые цисты формируются в течении недели с момента инфицирования. Неизвестно, какое время этот процесс занимает у относительно иммунологически незрелого плода. Переход от острофазной формы тахизоита, отвечающей за поражение клеток к спящей форме брадизоита в тканевых цистах, недостижимой для антибиотикотерапии, играет важную роль в «терапевтическом окне».
От 1 до 8 случав на 1000 беременностей, наиболее высокий уровень зарегистрирован во Франции.
Острая инфекция у матери, как правило, протекает бессимптомно. Если симптомы все-таки возникают, они неспецифичны – слабость, лихорадка, головные боли, недомогание и миалгия. Лимфоаденопатия является более специфичным признаком болезни. Вот почему токсоплазмоз при беременности диагностируется с трудом.
Беременные женщины с симптомами заболевания, подобными мононуклеозу, но с негативным гетерофильным тестом, должны пройти анализ на токсоплазмоз. Инфекция во время беременности наиболее точно диагностируется, когда как минимум два образца крови, исследованные с разницей минимум две недели, показывают сероконверсию от отрицательных показателей IgG и IgM к токсоплазме к положительным.
В части стран Европы практикуется проведение повторных тестов раз в месяц или раз в три месяца. Чем чаще проводится анализ на токсоплазмоз, тем выше шанс раннего обнаружения инфекции, когда лечение наиболее эффективно. Однако стоимость частых исследований и возможность получения ложноположительных результатов увеличиваются при увеличении частоты проведения исследования. В результате чего, женщине могут быть назначены ненужные ей инвазивные исследования и лечение. Потенциальный вред должен быть взвешен вместе с потенциальной пользой от лечения.
В США врачи-клиницисты, как правило, сталкиваются с необходимостью интерпретировать положительный тест авидности, полученный из единичного образца. Ни один из этих тестов достоверно не подтверждает недавнее инфицирование. Хотя выработка IgM длится от 10 до 13 месяцев, в зависимости от использованной методики, невозможно исключить индивидуальные особенности пациентов, и ¼ инфицированных женщин имеют положительный IgM-ответ в течение нескольких лет. Для женщин, чей первый тест на сроке 13 недель был положительным, возможность инфицирования после зачатия составляет 1-3%. Хотя высокая авидность IgG является признаком латентной инфекции, низкая авидность не является диагностическим признаком острой инфекции. Антитела IgG низкой авидности в некоторых случаях могут выявляться в течении нескольких лет.
Полезность определения титра антител igG никогда не была полностью оценена, и предположительно, имеет низкую воспроизводимость. Однако сочетание положительного результата на антитела IgM и отрицательного результата на антитела IgG, когда оба анализа на токсоплазмоз становятся положительными через две недели, таким образом исключая неспецифику, является признаком того, что инфицирование произошло примерно за две недели до получения первого положительного результата IgM.
Анализы на токсоплазмоз:
Риск инфицирования плода резко возрастает со сроком гестации на время сероконверсии. Риск трансмиссии по результатам статистических исследований составляет 15% при сероконверсии матери на сроке 13 недель, 44% - на 26 неделях, и 71% - на 36 неделях. Хотя эти исследования основаны на группах из получавших лечение женщин, вероятно, с их помощью можно оценить риски и у не пролечившихся женщин, так как доказательств эффективности получаемой терапии для снижения риска трансмиссии токсоплазмы гондии от матери к плоду, до сих пор не получено.
Иммунокомпетентные женщины, зараженные до беременности, не заражают плод, хотя отмечены редкие исключения. Женщины с иммунодефицитом могут страдать паразитемией в течение беременности, несмотря на то, что заражение произошло до беременности. У таких женщин имеется риск внутриутробного заражения плода.
Врожденная токсоплазма гондии является довольно редким явлением; его случаи были зафиксированы у шести женщин в течении последних 30 лет. Один документально зафиксированный случай демонстрирует, что предшествовавший иммунитет к токоплазме не защитил от реинфекции атипичным штаммом.
Последствия для плода. Для диагностики возможно использования УЗИ, однако, УЗ-признаки поражения плода неспецифичны. Наиболее характерные признаки - гиперэхогенные внутричерепные очаги или кальцификаты, расширение желудочков мозга – являются показателями неблагоприятного прогноза. Расширение желудочков мозга как правило происходит симметрично с обоих сторон. В одном из 32 подтвержденных случаев, развитие дилатации происходило очень быстро, в течении нескольких дней. В европейских исследованиях ненормальные сонографические признаки внутричерепных кальцификатов и расширения желудочков были найдены в 7% случаев (14 из 218 зараженных плодов). Однако, как было отмечено в других исследованиях, такие поражения повлялись только после 21 недели гестации. Ненормальные участки, поражающие другие органы (например, асцит) менее специфичны для токсоплазмы. Увеличенная толщина и плотность плаценты, асцит, уплотнение печени, реже – перикардиальные и плевральные выпоты так же обнаруживались. Повторное УЗИ может быть рекомендовано при рассмотрении варианта прерывания беременности на поздних сроках.
Микроцефалия и ЗВРП как правило, не характерны для врожденного токсоплазмоза. Редким осложнением также является выкидыш. В европейских когортных исследованиях 1208 инфицированных женщин риск выкидыша в первом триместре, выявленный у 448 женщин, был не выше подобного риска у контрольной группы. Связь между преждевременными родами и инфекцией токсоплазма гондии так же может быть скорее обусловлена вмешательством в родовой процесс, а не самой инфекцией.
Основной целью пренатальной диагностики инфицирования плода является подбор терапии со сменой спирамицина на пириетамин-сульфонамидный препарат. Поскольку пренатальная диагностика требует амниоцентеза, который является инвазивным тестом с маленькой, но подтвержденной вероятностью выкидыша, клиницисты должны убедиться в достаточной информированности женщины, чтобы позволить им взвесить все «за и против» инвазивной диагностики. Хотя рандомизированных исследований, сравнивающих типы лечения, не проводилось, сравнительные когортные исследования не предоставили свидетельство, что пириметамин более эффективен для лечения инфекции токсоплазмоз.
Для некоторых женщин пренатальная диагностика – существенное подспорье для решения вопроса о прерывании беременности. Исключение инфекции плода путем пренатальной диагностики также может предотвратить ненужное постнатальную терапию у детей без клинических симптомов токсоплазмоза и с низким риском развития инфекции.
ПЦР амниотической жидкости на наличие ДНК токсоплазмы – лучший метод диагностики инфекции плода, но его точность зависит от лаборатории и применяемой им методом, а чувствительность ниже на ранних сроках гестации (меньше 18 недель). Real-time ПЦР по-видимому, более чувствительный метод, чем ПЦР по конечной точке, но коммерчески недоступный. Чувствительность реал-тайм ПЦР была продемонстрирована французскими исследованиями по обнаружению токсоплазмы методом реал-тайм ПЦР, с полученными значениями чувствительности и специфичности 92,2% и 100% соответственно. Чувствительность не зависела от срока гестации. Четверо из 51 зараженных младенцев имели негативный результат ПЦР амниотической жидкости; сероконверсия матери в данных случаях произошла на сроках 13, 20, 28 и 32 недели.
Эти четыре ложно-отрицательных результата были получены на сроке 5-9 недель после сероконверсии матери, таким образом, время проведения амниоцентеза скорее всего не оказало влияния. Более того, как минимум одно исследование сообщало, что отсутствует связь между положительным результатом анализа и временем, прошедшим после сероконверсии, таким образом ставя под вопрос прежние рекомендации о проведении амниоцентеза после четырех недель с момента сероконверсии.
Некоторые клиницисты рекомендуют УЗИ для выявления нарушений развития плода у женщин с отрицательным результатом ПЦР амниотической жидкости. Однако, эта стратегия подвергает большое количество незараженных плодов излишнему количеству УЗ-исследований.
После родов, плацентарные признаки инфекции токсоплазмоз включают – гранулемы, цисты, децидуит, склероз и тромбоз хориоических сосудов.
На токсоплазмоз лечение во время беременности действует достаточно эффективно. Подход к нему во многом был основан на исследования Десмонта и Кувьера, которые 40 лет назад заявили, что лечение спирамицином снижало риск развития внутриутробного токсоплазмоза у плода. Однако в их работе был недочет – они не брали во внимание, что женщины, подвергавшиеся лечению, сероконвертировались на ранних сроках беременности, и таким образом, были в группе низкого риска инфицирования плода, а не пролечившиеся женщины скорее всего сероконвертировались на поздних сроках, и риск заражения плода был у них выше. В итоге эти данные были опровергнуты серией когортных исследований.
Факт того, что лечение снижает риск трансмиссии инфекции от матери к плоду, остается спорным, так как рандомизированное контролируемое испытание не проводилось. Самое явное подтверждение исходит из мета-анализа на уровне единичного пациента 20 европейских когортных исследований (1438 женщин), для которых проводился универсальный скрининг токсоплазмоза. Исследовались эффекты времени проведения терапии и вида терапии на передачу возбудителя от матери к плоду и клинической манифестации заболевания у детей до года. Виды пренатальной терапии включали в себя применение спирамицина, пириметамина-сульфониламида, а также применение спирамицина с последующим назначением пириметамин-сульфониламидов.
Было обнаружено небольшое свидетельство того, что на токсоплазмоз лечение, начатое в течении трех недель после сероконверсии, действует как снижающее риск передачи возбудителя плоду по сравнению с терапией, начатой в течение 8 недель после сероконверсии, но не удалось определить, было ли это реальным терапевтическим эффектом или неточностью, связанной с поздним обнаружением инфекции и включением пациентки в когорту. Только одна из пяти женщин была пролечена в течении трех недель с момента сероконверсии. Таким образом, даже если терапия эффективна, трудно определить и вовремя назначит лечение женщине сразу после сероконверсии.
В дополнение, не было обнаружено статистически значимого свидетельства снижения риска внутричерепных аномалий, обнаруженных после рождения, или ретинохороидита, выявленного во время младенчества. Два других когортных исследования также не выявили свидетельства, что терапия снижает риск развития ретинохороидита у детей дошкольного возраста. Однако есть точное свидетельство того, что терапия снижает риск постнатальной гибели младенца с врожденным токсоплазмозом. В европейском исследовании, в которое было включено 293 инфицированных плода, 8 процентов имели серьезные неврологические нарушения. Авторы предположили, что пренатальная терапия снижает риск серьезных неврологических последствий или гибели плода на 3/4. Они также предположили, что для предотвращения одного случая развития неврологической патологии после инфицирования матери на 10 неделе беременности, необходимо пролечить три плода с подтвержденной инфекцией. Чтобы предупредить один случай неврологической патологии или гибели плода при инфицировании на 30 неделе, необходимо провести терапию 18 плодов.
Есть свидетельство, полученное при когортных исследованиях, что терапия комбинацией пириметамина-сульфониламида не обладает большей эффективностью по сравнению с терапией спирамицином. Тем более, комбинация пириметамина-сульфониламида – довольно широко распространенный вариант, основанный на том, что уровень спирамицина в крови плода как правило, в два раза меньше уровня спирамицина в крови матери, что может быть недостаточно для лечения инфекции. Однако, эта информация остается спорной, учитывая трудность в измерении уровня спирамицина и разнице в концентрации препарата в крови у разных пациенток.
Недостаток свидетельств, что пириметамина-сульфониламида не обладает большей эффективностью по сравнению с другими препаратами, очень важен, так как он подрывает рациональность пренатальной диагностики. Клиницисты и пациентки должны понимать, что неизвестно, благотворна ли смена препарата при терапии в случае, если плод инфицирован.
Побочные эффекты наиболее часты при терапии пириметамин-сульфониламидом, чем от спирамицина, использующегося при токсоплазмозе для лечения. В европейских когортных исследованиях было выявлено, что побочные эффекты в 3,4% (11 из 322 пациенток) случаев требовали прекращения терапии пириметамин-сульфониламидом. Для сравнения, при терапии спирамицином этот показатель составил 1,7 %. Проспективное исследование, включавшее 48 детей с внутриутробным токсоплазмозом, выявленным при пренатальном скрининговом исследовании, показало, что 7 пациентов испытывали негативные последствия, приведшие к отмене лечения. У 6 из 7 пациентов с побочными эффектами наблюдалась нейтропения.
В итоге, есть свидетельства того, что пренатальная терапия снижает риск неврологических нарушений при врожденном токсоплазмозе, но нет свидетельств того, что происходит снижение риска глазных патологий, нарушения зрения или передачи инфекции от матери плоду. Для определения того, сопоставима ли польза терапии с потенциальными побочными эффектами и ценой, необходимы рандомизированные исследования. Однако, если токсоплазмоз выявлен у пациентки с симптомами заболевания или высоким риском заражения инфекцией, назначение терапии справедливо, но ее тип и продолжительность все еще не обозначены четко.
Несмотря на недостаток свидетельств об эффективности, пренатальная терапия обычно назначается беременным женщинам с диагностированным токсоплазмозом у человека. Перед принятием решения о назначении терапии женщине стоит объяснить вопросы, связанные с эффективностью лечения, риском побочных эффектов и возможностью того, что ребенок может быть здоров.
Как правило, пациентки, заразившиеся во время беременности, немедленно получают терапию спирамицином (1 г перорально каждые восемь часов вне приема пищи), который является макролидным антибиотиком, сходным с эритромицином. Он накапливается в плаценте, и считается, что это в теории помогает предотвратить передачу возбудителя плоду.
Пириметамин является антагонистом фолиевой кислоты, который может вызывать подавление костного мозга, и как следствие – анемию, лейкопению и тромбоцитопения. В больших дозах является тератогеном. Сульфадиазин также является антагонистом фолиевой кислоты, при лечении токсоплазмоза работает в синергии с пириметамином и также может вызывать супрессию костного мозга и обратимую острую почечную недостаточность. Ввиду потенциальной токсичности этих препаратов, их использование во время беременности должно быть обосновано только при документированной инфекции плода, хотя клинических свидетельств, что эти лекарства более эффективны, чем спирамицин.
В животных моделях и у людей с приобретенным синдромом иммунодефицита для лечения токсоплазмоза успешно использовался азитромицин. Этот препарат также успешно использовался для лечения хламидиоза во время беременности. Необходимы клинические испытания, является ли азитромицин или кларитромицин эффективной альтернативой спирамицину для профилактики инфицирования плода токсоплазмозом. Пириметамин (100 мг разово перорально, затем 25-50 мг в день) в сочетании с азитромицином (500 мог в день) имели эквивалентный эффект в рандомизированных исследованиях по сравнению с сульфониламидами у пациентов с ретинохороидитом, вызванным T. Gondii (токсоплазмоз у человека). Женщины с непереносимостью пириметамина могут получать терапию триметоприм-сульфаметоксазолом или клиндамицином. Однако безопасность применения данных препаратов у беременных пациенток еще неизвестна.
Профилактика первичного инфицирования основывается на избегании контакта с источником. Несмотря на то, что осведомленность и доступность информации об источниках инфекции, без сомнения, крайне важна, систематические проверки не нашли доказательство, что осведомленность населения влияет на поведение женщин во время беременности. Свидетельства исследований в Европе выделяют следующие возможности для заражения токсоплазмозом:
Данные о том, на чем необходимо базировать отсрочку беременности после перенесенной острой инфекции токсоплазмоз, крайне ограничены. Хотя рекомендуется отсрочка в шесть месяцев, паразитемия при токсоплазмозе очень скоротечна, и, вероятнее всего, уход паразита в стадию цист у женщины с адекватной иммунной реакцией произойдет быстро. Таким образом, иммунокомпетентные женщины, которые забеременели в срок от трех месяцев после перенесенной острой инфекции, навряд ли передадут инфекцию плоду. При изучении паразитемии после острой инфекции из 54 пациентов ни у одного не наблюдалось положительного результата ПЦР крови в срок 21-25 недель после начала лимфоаденопатии, и данные систематического обзора врожденного токсоплазмоза предполагают, что врожденная инфекция имеет место быть в течении трех недель после инфекции матери.
Реактивация латентного токсоплазмоза во время беременности может проявляться у ВИЧ-инфицированных женщин, особенно у пациенток с серьезно ослабленным иммунитетом. В объединенных европейских исследованиях, крупное проспективное исследование детей, рожденных от ВИЧ-инфицированных пациенток, 451 ребенок, участвовавший в исследовании, был рожден от матерей с наличием антител IgG к токсоплазме, и ни у кого из этих детей не было клинического свидетельства врожденного токсоплазмоза. В подгруппе из 71 ребенка врожденная инфекция была исключена серологическими исследованиями. Эти выводы позволяют предположить очень низкий риск трансмиссии паразита от матери к плоду со статистическим верхним пределом приблизительно 4%. Однако, большинство женщин, участвовавших в исследовании, не проявляли клинических симптомов, и риск трансмиссии у ВИЧ-инфицированных женщин со слабым иммунитетом может выше.
Смотрите также: ToRCH-инфекции и беременность
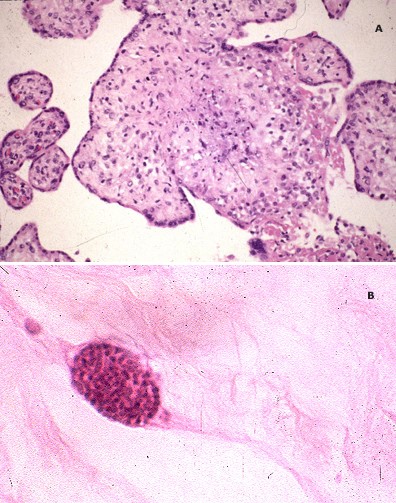
Toxoplasmosis of the placenta
Image
(A) Granulomatous villitis (B) Trophozoites.
Courtesy of Drucilla J Roberts, MD.
Источник: UpToDate, Toxoplasmosis and pregnancy. Ruth Gilbert, MD, Eskild Petersen, MD, DMSc, DTM&H. 2013